Научные статьи
-
Оценка структуры популяции эритроцитов эритроцитсодержащих сред, находящихся на хранении в банке крови, по данным атомно-силовой микроскопии. И.М. Ламзин, Р.М. Хайруллин, М.Э. Хапман, 2014
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ.
Научно – практический журнал.
Том 7, выпуск 5 2014г.
© И.М. Ламзин, Р.М. Хайруллин, М.Э. Хапман, 2014 УДК 616.155.1-076.5
Оценка структуры популяции эритроцитов эритроцитсодержащих сред, находящихся на хранении в банке крови, по данным атомно-силовой микроскопии
ИВАН МИХАЙЛОВИЧ ЛАМЗИН. аспирант кафедры анатомии человека ФГБОУ ВПО «Ульяновский государственный университет» Министерства образования и науки Российской Федерации, Ульяновск, Россия, тел. 8-917-633-34-26, e-mail: ivanlamzin@gmail.com
РАДИК МАГЗИНУРОВИЧ ХАЙРУЛЛИН, докт. мед. наук, профессор, зав. кафедрой анатомии человека ФГБОУ ВПО «Ульяновский государственный университет» Министерства образования и науки Российской Федерации, Ульяновск, Россия, тел. 8-842-232-65-65, e-mail: prof.khayrullin@gmail.com МАРАТ ЭРИКОВИЧ ХАПМАН, канд. мед. наук, главный врач ГУЗ «Ульяновская станция переливания крови Министерства здравоохранения Российской Федерации», Ульяновск, Россия, тел. 8-842-232-54-80, e-mail: ospk@mv.ru
Реферат. Большое количество исследований посвящено изучению морфологической и функциональной разнородности эритроцитной популяции здорового человека. До настоящего момента качественные отличия между отдельными эритроцитами одного образца изучались, например, при определении их стойкости к гемолитикам различной природы. Современным методом, позволяющим визуализировать клетки и исследовать их биофизические свойства, является атомно-силовая микроскопия. Одним из биофизических критериев, позволяющим судить о состоянии клетки, является упругость. По степени изменений упругости мембраны можно судить о выраженности деструктивных процессов старения клеток. Целью данной работы было на основании такого критерия, как упругость клетки, исследовать разнородность популяции эритроцитов эритроцитсодержащих сред на разных этапах их хранения. Материал и методы. Были исследованы пять серий сухих цитологических препаратов (мазков) эритроцитов: первая серия — препараты, приготовленные из эритроцитсодержащих сред в день заготовки, во вторую, третью, четвертую и пятую серии были включены сухие препараты эритроцитов, приготовленные из эритроцитсодержащих сред, находящихся на хранении в банке крови при 1=4°С в течение 7, 14, 21 и 35 сут соответственно. Для получения эритроцитсодержащих сред использовалась кровь, заготовленная в гемаконы фирмы «Baxter» (США) с консервантом «CPDA-1». После построения изображения с помощью атомно-силового микроскопа на препарате выбиралось 5 эритроцитов в случайном порядке, на каждом из которых упругость мембраны измерялась в 9 точках, далее вычислялось среднее арифметическое значение модуля Юнга для каждой клетки. Всего было исследовано 220 эритроцитов из 44 образцов. Значения модуля Юнга каждой из серий образцов распределялись по сформированным интервалам с шагом в 0,4 KPa, с дальнейшим вычислением процентных соотношений и их записью в виде эритроцитарной формулы для каждого периода хранения. Заключение. В ходе настоящего исследования показана динамика изменения пропорции эритроцитарной популяции эритроцитсодержащих сред по такому биофизическому показателю, как упругость. Сканирование с помощью атомно-силового микроскопа выявило наличие в эритроцитсодержащих средах клеток, значительно различающихся по своим биофизическим свойствам, а следовательно, и возрасту, что необходимо учитывать при формировании выводов об их качестве и пригодности к трансфузии.
Ключевые слова: эритроциты, атомно-силовая микроскопия, модуль Юнга, эритроцитсодержащие среды, старение клеток, эритроцитарная формула.
a analysis of changes population structure of stored red blood cells using atomic force microscopy
IVAN М. LAMZIN, postgraduate student of the Department of Human Anatomy, FSBEIHPE «Ulyanovsk State University», Ministry of Education and Science of Russian Federation, Ulyanovsk, Russia, tel. 8-917-633-34-26, e-mail: ivanlamzin@gmail.com
RADIK М. KHAYRuLLIN, MD, Professor, Chief of Chair of Human Anatomy,
FSBEI HPE «Ulyanovsk State University», Ministry of Education and Science of Russian Federation, Ulyanovsk,
Russia, tel. 8-842-232-65-65, e-mail: prof.khayrullin@gmail.com
Marat Е. HApMAN, PHD, Head doctor of Ulyanovsk Blood Center, of Ministry of Health
of Russian Federation, Ulyanovsk, Russia, tel. 8-842-232-54-80, e-mail: ospk@mv.ru
Abstract. A big number of researches have been dedicated to the examining of the morphological and functional diversity of the erythrocyte population of healthy human beings. Up till now qualitative differences between separate erythrocytes of the sample have been studied, for example, while checking their tolerance to various hemolytic substances. An atomic-force microscopy is a modern method that gives an opportunity to visualize cells and investigate their biophysical characteristics. One of the biophysical criterions that enable to assess the quality of the cell is its stiffness. The degree of the stiffness changes can show the extent of the destructive processes of the cell ageing. The aim of this work was to investigate the age heterogeneity of the erythrocyte population of the stored red blood cells at different stages of storing according to the criterion of the cell stiffness. Material and methods. 5 series of dry cytosmears of the red blood cells have been investigated: specimens of the first series were made of red blood cells on the first day of the storing; the second, third, fourth, and fifth series included dry specimens of the stored red blood cells which had been kept in blood bank at a temperature 4°С for 7, 14, 21 and 35 days respectively. Stored red blood cells were taken from blood packed in blood bags «Baxter» (USA) with the use of the additive «CPDA-1». After imaging with atomic force microscope, 5 RBC were chosen randomly in every specimen; on each of them membrane stiffness was checked in 9 points. Then the mean value of Young modulus was calculated for each cell. The numbers of the measures were total 220 erythrocytes out of 44 specimens. Young modulus values of each series of the samples was distributed over intervals formed with the step 0,4 KPa, with subsequent calculation of percentages and forming the erythrocyte formula for each storage period. Conclusion. The present study shows the dynamics of changes in the erythrocyte population heterogeneity according to such biophysical parameter as cells stiffness. The AFM studying revealed the biophysical and «age» heterogeneity of the population of stored red blood cells that must be considered while forming the conclusion about their quality. Key words: erythrocytes, atomic-force microscopy, Young's modulus (YM), stored red blood cells (sRBC), cells ageing, erythrocyte formula.
Введение. С момента изобретения атомно-силового микроскопа (АСМ) проведено большое количество исследований, посвященных его применению в клеточной биологии и медицине. Многие из них демонстрируют возможности АСМ по визуализации биообъектов с высоким разрешением и измерению их биофизических свойств. Одними из наиболее удобных для сканирования АСМ биообъектов являются эритроциты человека, они легко получаемы, четко отграничены друг от друга в цитологических препаратах, обладают характерной формой и сохраняют структурные особенности [1]. Сохранность обусловлена наличием развитого примембранного цитоскелета — белковой сети правильной двумерной формы, состоящей из нескольких типов белков: спектрина, актина, анкирина и др. [2].
Установлено, что в норме эритроциты не представляют собой однородную массу клеток, выявляемую при микроскопировании мазка или препарата нативных эритроцитов, а образуют систему, в которой сочетаются клетки различных возрастов, морфологии и функционального состояния. Зрелые эритроциты после выхода в кровоток являются высокоспецифичными клетками, не имеют ядра и большинства органелл и не способны к делению. В процессе их циркуляции в кровяном русле из механизмов прогрессирования старения на первый план выходят свободнорадикальное повреждение мембраны эритроцитов, изменение их липидного состава, истощение ферментативных систем гликолиза и запасов АТФ, замедление репаративных процессов цитоскелета и изменение ионного состава клетки в результате повышения проницаемости мембраны [3]. Прогрессирование повреждения эритроцитов с течением времени обусловлено высокими концентрациями кислорода внутри клеток в ходе выполнения ими кислородтранспортной функции [4]. При старении эритроцит последовательно проходит этапы превращения в эхиноцит I, II, III, IV класса, теряет способность изменять и восстанавливать дисковидную форму, превращается в сфероэхиноцит и разрушается. В мазках крови здоровых людей эхиноциты составляют до 6% от всех разновидностей эритроцитов.
Качественная разнородность эритроцитарной системы подтверждается тестами на резистентность. Кривая распределения эритроцитов по их стойкости в физиологических условиях отражает одновременное присутствие в крови нескольких различающихся между собой серий клеток. По выраженности изменений биофизических свойств мембраны и формы эритроцитов можно судить о деструктивных процессах старения эритроцитов эритро-цитсодержащих сред [5]. Одним из важнейших свойств эритроцита является его способность к деформации. Деформируемость эритроцитов претерпевает значительные изменения с возрастом и напрямую связана с такой биофизической характеристикой клетки, как упругость. Современным методом, позволяющим измерить значения упругости биологического объекта без разрушения в воздушной или жидкой средах, является АСМ. Использование данного метода в биологии и медицине позволяет исследовать динамические процессы так, как они происходят in vivo [6]. Работ, посвященных изучению возрастной гетерогенности популяции консервированных эритроцитов в процессе их длительного хранения, в современной научной литературе найдено не было. Целью данной работы является исследование динамики смены популяций эритроцитов эритроцитсодержащих сред с разными значениями модуля Юнга (МЮ) в процессе их хранения в течение 35 сут при стандартных температурных условиях.
Материал и методы. Исследование было выполнено в соответствии с требованиями действующего законодательства РФ, этических норм и принципов Хельсинкой декларации (1964) со всеми последующими дополнениями и изменениями, регламентирующими научные исследования на биоматериалах, а также международным руководством для биомедицинских исследований с вовлечением человека (International ethical guidelines for biomedical research involving human subjects) Совета международных организаций медицинских наук (CIOMS). Протокол исследования был одобрен Этическим комитетом Ульяновского государственного университета Министерства образования и науки РФ. Для исследования с помощью случайного бесповторного метода были отобраны 44 образца эритроцитсодержащих сред, заготовленных в ГУЗ «Ульяновская областная станция переливания крови» в гемаконы фирмы «Baxter» (США), содержащих консервант «CPDA-1», в объеме 450 мл. Образцы были разделены на 5 исследуемых серий. В первой серии были сгруппированы сухие препараты эритроцитов, приготовленные из эритроцитсодержащих сред в день донации. Во вторую, третью, четвертую и пятую серии были включены сухие препараты эритроцитов, приготовленные из эритроцитсодержащих сред, находящихся на хранении в банке крови при T=4X в течение 7, 14, 21 и 35 сут соответственно.
Сухие препараты эритроцитов готовились из эри-троцитсодержащих сред, хранящихся в гемаконах, с использованием консерванта. Перед исследованием эритроцитсодержащая среда в гемаконе плавно перемешивалась, вскрывался штуцер гемакона, капля крови наносилась на предметное стекло и равномерно распределялась шпателем. Препарат высушивался на воздухе в течение 20 мин при комнатной температуре и далее подвергался сканированию АСМ. Сканирование проводилось с помощью атомно-силового микроскопа фирмы «NT-MDT» (Россия), модель «SOLVER P47-Pro», оснащенного титановым кантилевером с радиусом закругления 10 нм и специализированного программного обеспечения «Nova» V1.1.0.1847. Применялся полуконтактный метод с генерируемой частотой 300 kHz. Сканируемая площадь образца составляла 120*120 nm. На каждом препарате в случайном порядке выбирались пять эритроцитов, измерялись их диаметр и высота, на мембране каждого эритроцита в 9 точках исследовалась упругость в соответствии с максимальной технической возможностью используемой модели прибора, с дальнейшим вычислением среднего арифметического значения МЮ по каждой сканированной клетке. В первой серии было сканировано 40 эритроцитов. Во второй, третьей и четвертой исследуемых сериях образцов было сканировано по 25 эритроцитов, в пятой серии — 105 эритроцитов. Общее количество измерений в исследовании составило 1980 (220 клеток из 44 проб). Данные обрабатывались с использованием прилагаемой к микроскопу компьютерной программы «Nova» для построения графика силовых кривых и количественной оценки упругости мембраны эритроцитов.
Количественная оценка упругости мембраны проводилась с помощью вычисления модуля Юнга. Полученные в процессе сканирования силовые кривые использовались для расчета значения МЮ эритроцитов каждой из групп. Для расчета значения МЮ по силовым кривым использовалась модель Герца [7]. Сила воздействия зонда в зависимости от глубины его проникновения в поверхность субстрата определяется выражением:
F=—ExAh1 ,
где F — сила, действующая на образец; R — радиус закругления зонда; Ah — глубина проникновения в поверхность; E — модуль Юнга.
Учитывая радиус закругления кантилеверов, которые использовались в данном исследовании, выводили формулу определения модуля Юнга:
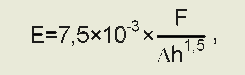
где F — Лу силового графика; Ah — Ax силового графика.
Для Л x и Л у на графике программы «Nova» выбиралась область линейного изменения значений силовой кривой нажатия кантилевера на поверхность эритроцита.
Значения МЮ каждой из серий образцов распределялись по сформированным интервалам с шагом в 0,4 KPa с целью наглядного отражения динамики изменений возрастных пропорций эритроцитарных популяций эритроцитсодержащих сред в процессе хранения. В каждом интервале высчитывалось процентное количество значений клеток МЮ от всего массива измерений в рамках одной группы образцов. Далее полученные числовые значения записывались в виде формулы эритроцитарной популяции для каждого из выбранных этапов хранения эритроцитсодержащих сред.
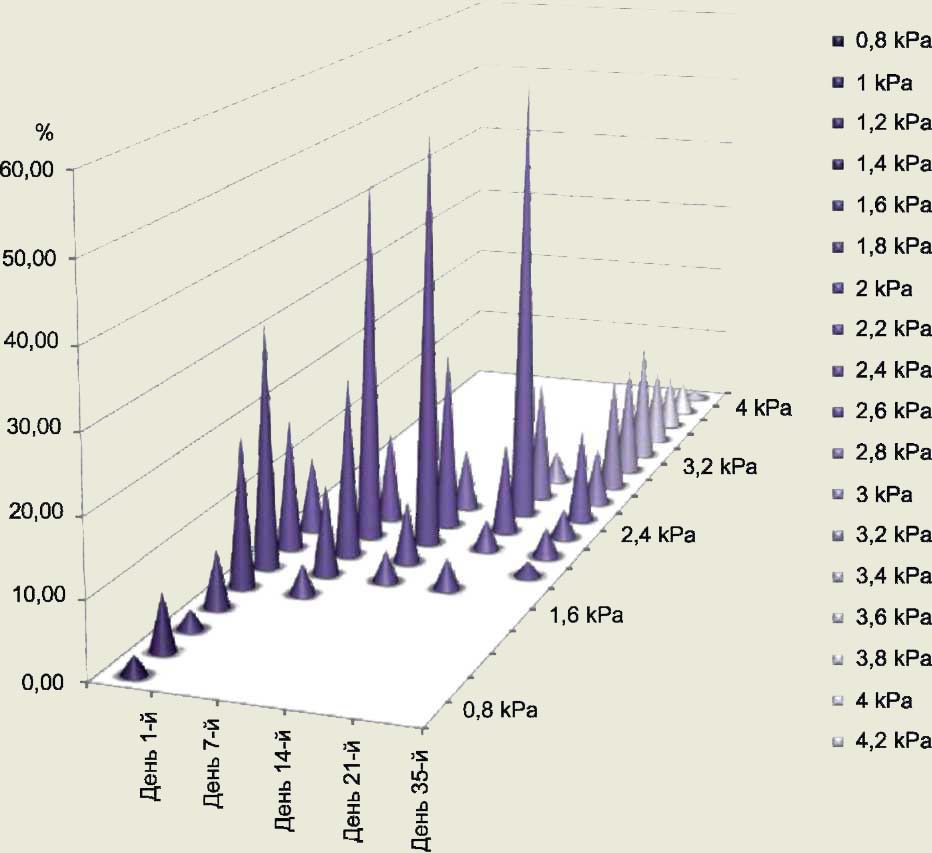
Результаты и их обсуждение. Значения МЮ эритроцитов 1-й серии образцов находятся в интервале от 0,8 до 2,4 KPa. Формула эритроцитарной популяции эритроцитсодержащих сред, хранящихся в течение суток, имеет следующий вид: 10%, 10%, 52,5%, 27,5%. Значения МЮ эритроцитов 2-й серии образцов меняются и смещаются в интервал от 1,6 до 2,6 KPa. Формула эритроцитарной популяции эритроцитсодержащих сред, находящихся на хранении 7 сут, — 16%, 72%, 12%. Значения МЮ эритроцитов 3-й серии образцов находятся в интервале от 1,8 до 2,8 KPa. Формула эритроцитарной популяции эритроцитсодержащих сред, находящихся на хранении 14 дней, — 4%, 64%, 32%. Значения МЮ эритроцитов 4-й серии образцов находятся в интервале от 1,8 до 3,2 KPa. Формула эритроцитарной популяции эритроцитсодержащих сред, находящихся на хранении 21 день, — 4%, 4%, 72%, 20%. Соотношение эритроцитов с увеличением времени их хранения претерпевает значительные изменения. Значения МЮ эритроцитов 5-й серии образцов находятся уже в интервале от 2,0 до 4,4 KPa. Формула эритроцитарной популяции эритроцитсодер-жащих сред, хранящихся в течение 35 дней, имеет следующий вид: 5,7%, 16,2%, 22,8%, 31,5%, 18,1%, 5,7%. Распределение значений МЮ эритроцитов пяти серий образцов по сформированным интервалам приведено в таблице. В графическом виде эти данные отображены на столбчатой диаграмме (рисунок).
Процентное распределение значений модуля Юнга эритроцитов пяти серий образцов по сформированным интервалам
Номер серии образцов
Интервалы значений модуля Юнга эритроцитов
0,8—1,2 KPa
1,2—1,6 KPa
1,6—2,0 KPa
2,0—2,4 KPa
2,4—2,8 KPa
2,8—3,2 KPa
3,2—3,6 KPa
3,6—4,0 KPa
4,0—4,4 KPa
1 (1-е сут), %
10
10
52,5
27,5
2 (7-е сут), %
16
72
12
3 (14-е сут), %
4
64
32
4 (21-е сут), %
4
4
72
20
5 (35-е сут), %
5,7
16,2
22,8
31,5
18,1
5,7
Вопрос возрастной гетерогенности эритроцитной популяции человека не является дискутабельным. Ряд работ посвящены изучению структуры эритрона in vivo с помощью биофизических методик, основанных на измерении степени снижения осмотической резистентности эритроцитов в процессе их старения [5]. Исследований, посвященных изучению изменения возрастной структуры популяции консервированных эритроцитов во время хранения в артифициальных условиях, в научной литературе не обнаружено. Современной технологией по исследованию состояния мембран биологических объектов является атомно-силовая микроскопия [8]. Она основана на принципах наноразмерных измерений, используется при изучении свойств мембран живых, суправитальных и фиксированных клеток, для детализации структуры их поверхности и определению упругости [1]. Метод показал себя чувствительным при выявлении ряда изменений формы эритроцитов, индуцированных различными химическими агентами [9]. Упругость мембраны эритроцитов сильно изменяется в процессе их старения и гибели [10]. Для сканирования эритроцитов в данной работе был использован прерывистый режим АСМ, который является оптимальным при исследовании биообразцов как в воздушной, так и жидкой средах. Для оценки качества эритроцитов готовились сухие мазки эритроцитсодержащих сред, так как высушивание эритроцитов практически не изменяет их форму и мембранные структуры [11, 12].
Настоящее исследование эритроцитов, хранящихся в эритроцитсодержащей среде, с помощью АСМ-технологии показало, что эритроцитарная популяция как в день консервации, так и на всем протяжении стандартного для данного типа консерванта срока годности сохраняет высокую степень гетерогенности по такому биофизическому показателю, как упругость. Так, в первый день хранения 20% сканированных эритроцитов имели значения МЮ в интервале 0,8 — 1,6 KPa. Эритроциты со значениями МЮ от 0,8 до 1,6 KPa характерны исключительно для первой серии и не встречаются в других сериях образцов. Во второй серии образцов происходит постепенное смещение значений МЮ с появлением 12% клеток, значения МЮ которых попадают в интервал 2,4 — 2,8 KPa. Через 14 сут хранения меняется распределение средних значений МЮ эритроцитов по сформированным интервалам. На 21-е сут хранения уже 20% эритроцитов попадают в интервал значений МЮ от 2,8 до 3,2 KPa. Отличительной особенностью пятой серии (35-е сут хранения) от других серий образцов является наличие 55,3% эритроцитов, находящихся в интервале значений МЮ от 3,2 KPa до 4,4 KPa. В данном контексте о клетках со значениями МЮ в интервале от 3,2 KPa до 4,4 KPa можно говорить как о маркерах «старения» эритроцитсодержащих сред. Выявление подобных эритроцитов можно использовать как критерий определения качества эритроцитсодержа-щих сред и формирования выводов об их пригодности к трансфузии. Гетерогенность эритроцитов по такому параметру, как упругость, выявленная в данной работе, наблюдается во всех сериях исследованных образцов. Данное явление, по-видимому, обусловлено тем, что изначально в кровотоке, а после консервации и в трансфузионных средах, находятся клетки различного «возраста». К концу срока годности компонента крови наблюдается большая разобщенность значений МЮ эритроцитов. На 35-е сут хранения в популяции эритроцитов наблюдается одновременное присутствие разнообразных по своим биофизическим свойствам клеток. Разброс значений пятой серии образцов охватывает 6 сформированных интервалов. Данное явление можно объяснить тем, что с течением времени происходит неравномерное расходование энергетических резервов вследствие оседания клеток на дно гемакона и отстаивания межклеточной жидкости, а также критического нарушения адаптационных свойств наиболее «старых» эритроцитов.
Заключение. В настоящей работе показано, что АСМ является современным нанотехнологическим инструментом для измерения упругости мембран эритроцитов эритроцитсодержащих сред. В ходе настоящего исследования показана динамика изменения пропорции эритроцитарной популяции эритроцитсодержащих сред по такому биофизическому показателю, как упругость, в процессе их хранения в течение 35 дней при стандартных температурных условиях. АСМ-сканирование выявило наличие в эритроцитсодержащих средах клеток, значительно различающихся по своим биофизическим свойствам, а следовательно, и возрасту, что необходимо учитывать при формировании выводов об их качестве и пригодности к трансфузии.
ЛИТЕРАТУРА
1. Gadegaard, N. Atomic force microscopy in biology: technology and techniques. / N. Gadegaard // Biotechnic & Histochemistry. — 2006. — Vol. 81. — P.87—97.
2. Lekka, M. Erythrocyte stiffness probed using atomic force microscope. / M. Lekka, M. Fornal, G. Pyka-Fosciak [et al.] // Biorheology. — 2005. — Vol. 42. — P.305—317.
3. Girasole, M. Structure and function in native and pathological erythrocytes: a quantitative view from the nanoscale / M. Girasole, S. Dinarelli, G. Boumis // Micron. — 2012. — Vol. 43, № 12. — P.1273—1286.
4. Barvitenko N.N. Erythrocyte signal transduction pathways, their oxygenation dependence and functional significance / N.N. Barvitenko, N.C. Adragna, R.E. Weber // Cell. Physiol. Biochem. — 2005. — № 15. — P.1—18.
5. Ламзин, И.М. Исследование изменений биофизических свойств эритроцитов при хранении в эритроцитсодер-жащих средах с помощью атомно-силовой микроскопии / И.М. Ламзин, Р.М. Хайруллин // Саратовский научно-медицинский журнал. — 2014. — Т. 10, № 1. — С.44—48.
6. Miklaszewska, M. New measurement techniques in biology and medicine: atomic force microscopy (part III) / M. Miklaszewska, M. Targosz, W. Sutowicz [et al.] // Przegl. Lek. — 2004. — Vol. 61, № 3. — P. 192—198.
7. Hertz, H. Uber die Beruhrung fester elastischer Korper / H. Hertz // Journal fur die reine und angewandte Mathematik. — 1881. — Vol. 92. — P.156—171.
8. A-Hassan, E. Relative Microelastic Mapping of Living Cells by Atomic Force Microscopy / E. A-Hassan, W.F. Heinz, M.D. Antonik [et al.] // Biophysical Journal. — 1998. — Vol. 74. — P.1564—1578.
9. Girasole, M. Artificially induced unusual shape of erythrocytes: an atomic force microscopy study / M. Girasole, A. Cricenti, R. Generosi [et al.] // Journal of Microscopy. — 2001. — Vol. 204. — P. 46—52.
10. Nikolaev, N.I. Changes in the stiffness of human mesenchymal stem cells with the progress of cell death as measured by atomic force microscopy / N.I. Nikolaev, T. Muller, D.J. Williams [et al.] // J. Biomech. — 2013. — Vol. 12. — Р. 1123—1129.
11. Takeuchi, M. Structure of the Erythrocyte Membrane Skeleton as Observed by Atomic Force Microscopy / M. Takeuchi, H. Miyamoto, Y. Sako // Biophys. J. — 1998. — Vol. 74, № 5. — P.2171—2183.
12. Zhang, P.C. Atomic force microscopy study of fine structures of the entire surface of red blood cells / P.C. Zhang, C. Bai, Y.M. Huang [et al.] // Scanning Microsc. — 1995. — Vol. 9, № 4. — P.981—989.
REFERENCES
1. Gadegaard, N. Atomic force microscopy in biology: technology and techniques. / N. Gadegaard // Biotechnic & Histochemistry. — 2006. — Vol. 81. — P.87—97.
2. Lekka, M. Erythrocyte stiffness probed using atomic force microscope. / M. Lekka, M. Fornal, G. Pyka-Fosciak [et al.] // Biorheology. — 2005. — Vol. 42. — P.305—317.
3. Girasole, M. Structure and function in native and pathological erythrocytes: a quantitative view from the nanoscale / M. Girasole, S. Dinarelli, G. Boumis // Micron. — 2012. — Vol. 43, № 12. — P.1273—1286.
4. Barvitenko N.N. Erythrocyte signal transduction pathways, their oxygenation dependence and functional significance / N.N. Barvitenko, N.C. Adragna, R.E. Weber // Cell. Physiol. Biochem. — 2005. — № 15. — P.1—18.
5. Lamzin, I.M. Issledovanie izmenenii biofizicheskih svoistv eritrocitov pri hranenii v eritrocitsoderzhaschih sredah s pomosch'yu atomno-silovoi mikroskopii [The study of changes of biophysical properties of red blood cells in storage in erythrocyte-containing solutions using atomic force microscopy] / I.M. Lamzin, R.M. Hairullin // Saratovskii nauchno-medicinskii zhurnal [Saratov Journal of Medical Scientific Research]. — 2014. — T. 10, № 1. — S.44—48.
6. Miklaszewska, M. New measurement techniques in biology and medicine: atomic force microscopy (part III) / M. Miklaszewska, M. Targosz, W. Sutowicz [et al.] // Przegl. Lek. — 2004. — Vol. 61, № 3. — P.192—198.
7. Hertz, H. Uber die Beruhrung fester elastischer Korper / H. Hertz // Journal fur die reine und angewandte Mathematik. — 1881. — Vol. 92. — P.156—171.
8. A-Hassan, E. Relative Microelastic Mapping of Living Cells by Atomic Force Microscopy / E. A-Hassan, W.F. Heinz, M.D. Antonik [et al.] // Biophysical Journal. — 1998. — Vol. 74. — P.1564—1578.
9. Girasole, M. Artificially induced unusual shape of erythrocytes: an atomic force microscopy study / M. Girasole, A. Cricenti, R. Generosi [et al.] // Journal of Microscopy. — 2001. —Vol. 204. — P.46—52.
10. Nikolaev, N.I. Changes in the stiffness of human mesenchymal stem cells with the progress of cell death as measured by atomic force microscopy / N.I. Nikolaev, T. Muller, D.J. Williams [et al.] // J. Biomech. — 2013. — Vol. 12. — Р.1123—1129.
11. Takeuchi, M. Structure of the Erythrocyte Membrane Skeleton as Observed by Atomic Force Microscopy / M. Takeuchi, H. Miyamoto, Y. Sako // Biophys. J. — 1998. — Vol. 74, № 5. — P.2171—2183.
12. Zhang, P.C. Atomic force microscopy study of fine structures of the entire surface of red blood cells / P.C. Zhang, C. Bai, Y.M. Huang [et al.] // Scanning Microsc. — 1995. — Vol. 9,№ 4. — P.981—989.
/ 19.01.2015