Научные статьи
-
Исследование изменений биофизических свойств эритроцитов При хранении в эритроцитсодержащих средах c помощью атомно-силовой микроскопии. Ламзин И.М., Харуллин P.M. 2014г.
САРАТОВСКИЙ НАУЧНО-МЕДИЦИНСКИЙ ЖУРНАЛ.
Том 10, №1 Январь – март 2014г.
УДК 611.018.51+612.111.6 Оригинальная статья.
ИССЛЕДОВАНИЕ ИЗМЕНЕНИЙ БИОФИЗИЧЕСКИХ СВОЙСТВ ЭРИТРОЦИТОВ
ПРИ ХРАНЕНИИ В ЭРИТРОЦИТСОДЕРЖАЩИХ СРЕДАХ
С ПОМОЩЬЮ АТОМНО-СИЛОВОЙ МИКРОСКОПИИ
И. М. Ламзин — ФГБОУ ВПО «Ульяновский государственный университет» Министерства образования и науки Российской Федерации, институт медицины, экологии и физической культуры, кафедра анатомии человека, аспирант; Р. М. Хайруллин — ФГБОУ ВПО «Ульяновский государственный университет» Министерства образования и науки Российской Федерации, институт медицины, экологии и физической культуры, заведующий кафедрой анатомии человека, профессор, доктор медицинских наук.
THE STUDY OF CHANGES OF BIOPHYSICAL PROPERTIES OF RED BLOOD CELLS IN STORAGE IN ERYTHROCYTE-CONTAINING SOLUTIONS USING ATOMIC FORCE MICROSCOPY
I.M. Lamzin— Ulyanovsk State University, Institute of Medicine, Ecology and Physical Culture, Department of Human Anatomy, Post-graduate; R.M. khayrullin — Ulyanovsk State University, Institute of Medicine, Ecology and Physical Culture, Head of Department of Human Anatomy, Professor, Doctor of Medical Science.
Дата поступления — 30.12.2013 г. Дата принятия в печать — 3.03.2014 г.
Ламзин И.М., Харуллин P.M. Исследование изменений биофизических свойств эритроцитов при хранении в эритроцитсодержащих средах с помощью атомно-силовой микроскопии. Саратовский научно-медицинский журнал 2014; 10(1): 44-48.
Ответственный автор — Хайруллин Радик Мапзинурович
Тел.: +78422326565
E-mail prof.khayrullin@gmail.com.
В настоящее время в отделах контроля качества центров крови пригодность эритроцитарных сред к клиническому применению косвенно оценивается с помощью рутинных методов определения концентрации гемоглобина, гематокрита или уровня гемолиза по окончанию срока хранения компонента крови. Перечисленные методы не могут непосредственно характеризовать состояние мембран консервированных эритроцитов. Цепью настоящей работы было исследование изменения упругости и поверхностного потенциала мембран эритроцитов эритроцитсодержащих сред в процессе хранения в течение 35 суток. Материал и методы. Исследованы две серии сухих цитологических препаратов (мазков) эритроцитов: первая серия — приготовленные из эритроцитсодержащих сред, в день консервации; вторая серия — после их хранения при t=4°C в течение 35 суток. Кровь заготавливалась в гемаконы фирмы «Baxter» (США) с консервантом CPDA-1. Первая группа содержала 8 образцов, вторая 20 образцов. Для атомно-силовой микроскопии на препарате выбирались 5 типичных эритроцитов, на каждом из которых упругость мембраны измерялась в 9 точках, всего было проведено 1296 измерений. Результаты. Среднее значение модуля Юнга в первой группе образцов составило 1,81 ±0,02 КРа (М±т), во второй группе — 3,22±0,02 КРа, что было статистически значимо выше (р<0,001). Установлено также повышение поверхностного потенциала мембран эритроцитов с течением срока хранения. Заключение. Статистически высоко значимое повышение средних значений модуля Юнга эритроцитов свидетельствует о снижении эластичности клеточной мембраны в процессе хранения эритроцитсодержащих сред при стандартных температурных условиях и может быть использовано в качестве критерия оценки их качества.
Ключевые слова: эритроциты, атомно-силовая микроскопия, модуль Юнга, эритроцитсодержащие среды.
Lamzin IM, Khayrullin R М. The study of changes of biophysical properties of red blood cells in storage in erythrocyte-containing solutions using atomic force microscopy. Saratov Journal of Medical Scientific Research 2014; 10(1): 44-48.
Currently the departments of quality control of blood centers evaluate the suitability for clinical use of erythrocyte-containing solutions indirectly by routine methods of the determination of hemoglobin concentration, hematocrit level, or hemolysis at the end of the period of storing. These methods can not directly characterize the state of membranes of preserved erythrocytes. The aim of the work is to study the changes of elasticity and surface potential of membranes of red blood cells of erythrocyte-containing solutions in storage for 35 days. Material and Methods. Two series of dry cytological preparations (smears) of erythrocytes have been investigated. The first group consisted of 8 samples of erythrocyte-containing solutions prepared on the day of preservation, and the second group included 20 samples prepared after the long term storage for 35 days at t=+4°C. Blood was stored in bags of «Baxter» company (USA) conserving with «CPDA-1». For atomic force microscopy five typical erythrocytes were selected and their elasticity was measured at 9 points of the membrane of each erythrocyte. Total number of measurements was 1296. Results. Average value of Young's modulus of the first group of samples was 1,81 ±0,02 (M±m) KPa. The second group showed 3,22±0,02 KPa statistically higher (p<0,001). The increase of the surface potential of erythrocyte membranes over the storage period was found. Conclusion. A statistically significant increase of the average value of Young's modulus of erythrocytes indicated the decrease in the elasticity of the cell membrane during their storage in erythrocyte-containing solutions under standard temperature conditions and could be used as a criterion for quality assessment.
Key words: erythrocytes, atomic force microscopy, Young's modulus, erythrocyte-containing solutions.
Введение. Рутинными методами определения пригодности эритроцитарных сред для трансфузии являются тест на концентрацию гемоглобина, определение гематокрита и степени гемолиза эритроцитов в конце срока их хранения [1]. Эти исследования могут дать лишь косвенную информацию о состоянии мембран эритроцитов, не подвергавшихся гемолизу, что не позволяет сделать выводы об их структурной и функциональной полноценности и, как следствие, о качестве переливаемого компонента крови. В то же время эритроциты являются объектом, хорошо визуализируемым при сканировании атомно-силовым микроскопом (АСМ), они четко отграничены друг от друга в цитологических препаратах, обладают характерной формой и сохраняют структурные особенности [2]. Сохранность обусловлена наличием развитого примембранного цитоскелета — белковой сети правильной двумерной формы, состоящей из нескольких типов белков: спектрина, актиан, анкирина, других [3]. Белки цитоскелета тесно связаны с трансмембранными каналами и рецепторами, что обуславливает зависимость между структурной целостностью клетки, формой, упругостью и ее функциональной активностью. В процессе старения эритроцитов уровень внутриклеточного АТФ снижается [4]. Энергетический дефицит приводит к замедлению внутриклеточных репаратив-ных перестроек структурных элементов цитоскелета. Эритроциты неуклонно теряют двояковогнутую форму, трансформируясь сначала в эхиноциты, а потом, непосредственно перед гемолизом, в сфероэхиноци-ты. Все эти структурные изменения должны сопровождаться изменениями биофизических характеристик их мембраны.
Цель: исследование биофизических свойств мембраны эритроцитов в процессе их хранения в эритроцитсодержащих средах с помощью АСМ в течение 35 суток при стандартных температурных условиях.
Материал и методы. Исследование выполнено в соответствии с требованиями действующего законодательства РФ, этических норм и принципов Декларации Хельсинки (1964) со всеми последующими дополнениями и изменениями, регламентирующими научные исследования на биоматериалах, а также
Международным руководством для биомедицинских исследований с вовлечением человека (International ethical guidelines for biomedical research involving human subjects) Совета международных организаций медицинских наук (CIOMS). Протокол исследования одобрен Этическим комитетом Ульяновского государственного университета Министерства образования и науки РФ. Для исследования с помощью случайного бесповторного метода отобраны 28 образцов эритроцитсодержащих сред, заготовленных в ГУЗ «Ульяновская областная станция переливания крови» в гемаконы фирмы «Baxter» (США), содержащих консервант «CPDA-1» в объеме 450 мл. Эти образцы были разделены на две группы. Восемь сухих препаратов из образцов первой группы сканировались в день консервации. Из других 20 гемаконов сухие препараты были приготовлены и сканированы спустя 35 суток хранения при t=+4° С.
Подготовка препаратов для АСМ-сканирования. Сухие препараты эритроцитов готовились из эритроцитсодержащих сред, хранящихся в гемаконах с использованием консерванта. Перед исследованием эритроцитсодержащая среда в гемаконе плавно перемешивалась, вскрывался штуцер гемакона, капля крови наносилась на предметное стекло и равномерно распределялась шлифованным стеклом. Препарат высушивался на воздухе 20 мин. при комнатной температуре и далее подвергался сканированию АСМ.
Атомно-силовая микроскопия. Сканирование проводилось с помощью атомно-силового микроскопа фирмы «NT-MDT» (Россия), модель «SOLVER Р47 — Рго», оснащенного титановым кантилевером с радиусом закругления 10 нм, и специализированного программного обеспечения «Nova» V1.1.0.1847. Применялся полуконтактный метод с генерируемой частотой 300 kHz. Сканируемая площадь образца составляла 120x120 nm. На каждом препарате в случайном порядке выбирались пять эритроцитов, на мембране каждого эритроцита упругость исследовалась в 9 точках в соответствии с максимальной технической возможностью используемой модели прибора. Общее количество измерений в исследовании составило 1260 (140 клеток из 28 проб). Данные обрабатывались с использованием прилагаемой к микроскопу компьютерной программы «Nova» для построения графика силовых кривых и количественной оценки упругости мембраны эритроцитов.
Вычисление модуля Юнга. Количественная оценка упругости мембраны производилась с помощью вычисления модуля Юнга (МЮ). Для расчета значения МЮ по силовым кривым использовалась модель Герца [5]. Сила воздействия зонда в зависимости от глубины его проникновения в поверхность субстрата определяется выражением:
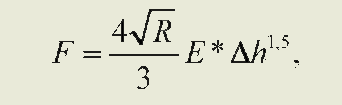
где F — сила, действующая на образец; R — радиус закругления зонда; Ah — глубина проникновения в поверхность; Е — модуль Юнга [6]. Учитывая радиус закругления кантилеверов, которые использовались в данном исследовании, выводили формулу определения МЮ:
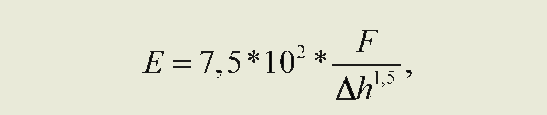
где F — Д у силового графика; Ah —Ах силового графика. Для Ах и Ау на графике программы «Nova» выбиралась область линейного изменения значений силовой кривой нажатия кантилевера на поверхность эритроцита.
С применением специального режима, предусмотренного для использования в работе АСМ, измерен поверхностный потенциал (ПП) мембран 29 и 30 эритроцитов обеих групп соответственно. Числовые значения ПП получены на изображениях препаратов в программе «Nova».
Статистическую обработку данных проводили с использованием лицензионной программы «Statistica 8.0» StatSoft Inc. (США) по правилам параметрической статистики, рекомендованным Международным комитетом редакторов биомедицинских журналов (ICMJE). Распределение полученных результатов проверялось на соответствие критериям нормальности. Были рассчитаны среднее арифметическое значение, его ошибка, стандартное отклонение, 95%-ный доверительный интервал, коэффициент вариации, различия средних значений оценивались с помощью критерия Стьюдента при уровне вероятности нулевой гипотезы р<0,05.

Результаты. В результате АСМ-сканирования сухих препаратов эритроцитсодержащих сред получены изображения красных кровяных телец, форма которых варьировала в зависимости от срока хранения компонента крови. На препарате эритроцитсодержа-щей среды, полученном в первые сутки консервации, форма эритроцитов типичная двояковогнутая, это преимущественно дискоциты (рис. 1), на поверхности сухого препарата эритроцитсодержащей среды после 35 суток хранения форма эритроцитов существенно изменена, превалируют эхиноциты и сферо-эхиноциты (рис. 2).
Полученные в процессе сканирования силовые кривые (рис. 3) использовались для расчета значения модуля Юнга эритроцитов каждой из групп. Распределение значений измерений соответствовало критериям нормальности. Среднее арифметическое значение МЮ в первой группе составило 1,81 ±0,02

(М±т) КРа (табл. 1). 95%-ный доверительный интервал находился в пределах 1,76*1,86 КРа, при размахе от 0,68 до 2,90. Значение МЮ второй группы образцов составило 3,22±0,02 КРа с доверительным интервалом 3,19-5-3,27 КРа, при размахе от 1,03 до 6,69 КРа. Среднее арифметическое значение первой группы образцов статистически значимо отличается от значения второй группы (значение критерия Стьюдента составило t=35,9 при уровне статистической значимости нулевой гипотезы р=0,001). Среднее арифметическое значение ПП в первой группе составило 1022,20±45,41 mV, во второй группе 1380,60±45,00 mV. Группа образцов первой группы по данному показателю также статистически высоко значимо отличается от образцов второй группы (значение критерия Стьюдента t=5,6 при уровне статистической значимости нулевой гипотезы р=0,000001).
Оба показателя имели высокий уровень вариабельности, оцениваемый по значению коэффициента вариации в пределах 17,9-21,6%.
Обсуждение. Вопрос оценки качества выпускаемых центрами крови ее компонентов является одним из самых острых в современной трансфузиологии, поскольку в настоящее время в протоколы терапии многих заболеваний и состояний включена их трансфузия с заместительной целью. В соответствии с нормативной документацией определение соответствия эритроцитсодержащей среды показателям, указанным в техническом регламенте, производится с помощью оценки уровня остаточного гемоглобина, гематокрита или степени гемолиза эритроцитов в конце срока хранения [1]. Однако с помощью подобных рутинных технологий невозможно охарактеризовать свойства мембран оставшихся не гемолизированны-ми эритроцитов в таких средах, а следовательно, и их истинное качество.
Современной технологией по исследованию состояния мембран биологических объектов является атомно-силовая микроскопия. Она основана на принципах наноразмерных измерений, используется при изучении свойств мембран живых, суправи-тальных и фиксированных клеток, для детализации структуры их поверхности и определению упругости [2]. Так, с помощью АСМ были визуализированы ряд изменений формы эритроцитов, индуцированных различными химическими агентами [7]. Группа авторов с помощью АСМ-сканирования выявила дефекты структуры мембран эритроцитов у пациентов с системной красной волчанкой [8]. С помощью АСМ было показано, что при гипертонической болезни и сахарном диабете пластичность мембраны эритроцитов снижается [3] и они теряют способность к эффективной циркуляции в капиллярах. Упругость мембраны эритроцитов может изменяться в процессе их консервации, сепарации и хранения.

Настоящее исследование эритроцитов, хранящихся в эритроцитсодержащей среде, с помощью АСМ-технологии показало, что МЮ красных кровяных телец после хранения в течение 35 дней значи¬тельно повышается по сравнению с первым днем. Нами установлено также, что форма консервированнных эритроцитов в процессе длительного хранения при стандартных температурных условиях, по даннным АСМ, претерпевает изменения, аналогичные выявляемым при оптической микроскопии. Если в день консервации в эритроцитсодержащей среде превалируют двояковогнутые дискоциты (см. рис. 1), то в конце срока хранения наблюдается большее колличество эхиноцитов и сфероэхиноцитов (см. рис. 2). По выраженности изменений биофизических свойств мембраны и формы эритроцитов можно судить о деструктивных процессах старения мембраны и при-мембранного цитоскелета, связанных со снижением запаса АТФ, перекисного и ферментативного окисления в эритроцитсодержащей среде, которые еще не приводят к гемолизу эритроцитов и не вызывают повышения в ней уровня свободного гемоглобина.
Почти двукратный рост модуля Юнга мембран эритроцитов в течение стандартного срока хранения свидетельствует о снижении упругости мембраны, поэтому срок жизни измененных эритроцитов должен быть более коротким, чем у двояковогнутых эритроцитов с низкими значениями МЮ. Судя по значениям коэффициента вариации исследованных биофизических параметров, можно сделать заключение о том, что эритроцитарная популяция, как в день консервации, так и в день окончания срока хранения, сохраняет высокую степень гетерогенности по биофизическим характеристикам мембраны. Эта гетерогенность, по-видимому, обусловлена тем, что в циркуляции находятся клетки разного «возраста». Нами установлен значительный разрыв крайних значений доверительного интервала МЮ первой серии образцов (1,76+1,86 КРа) и второй серии образцов (3,19+3,27 КРа) с отсутствием перекрывающихся значений. Это явление свидетельствует о том, что процессы старения эритроцитов, находящихся в естественной циркуляции в сосудистом русле, сопровождаются иной динамикой значений биофизических показателей мембраны, нежели у клеток, хранящихся в артифициальных условиях, что требует дальнейших исследований.
Повышение поверхностного потенциала мембран клеток в процессе хранения трудно интерпретируемо. Оно может быть связано как с изменениями ионного и молекулярного состава эритроцитсодержащей среды и фиксацией молекул на поверхности мембраны эритроцитов, так и с изменениями упругости и, соответственно, электрических свойств самой мембраны. Наиболее вероятным, однако, представляется, что рост поверхностного потенциала связан с изменением биохимического состава плазмы клетки и среды одновременно, в результате чего на сухом препарате фиксированные на мембране ионы изменяют ее потенциал.
Заключение. Показано, что АСМ, являясь современным нанотехнологическим инструментом для измерения локальной упругости мембран клеток, может быть использована для определения МЮ и ПП эритроцитов эритроцитсодержащих сред и других компонентов крови. В ходе настоящего исследования выявлено статистически значимое сопряженное повышение значений МЮ и ПП красных кровяных телец, сопровождающееся изменением их формы до эхиноцитов и сфероэхиноцитов после длительного хранения эритроцитсодержащих сред в течение 35 суток при стандартных температурных условиях +4°С. Таким образом, МЮ и ПП могут быть использованы в качестве непосредственных критериев оценки состояния мембран эритроцитов эритроцитсодержащих сред и других компонентов крови.
Конфликт интересов не заявляется.
References (Литература)
1. Tekhnicheskiy reglament о trebovaniyakh bezopasnosti krovi, ее produktov, krovezameshchayushchikh rastvorov i tekhnicheskikh sredstv, ispol'zuemykh v transfuzionno-infuzionnoy terapii. Utverzhden postanovleniem Pravitel'stva RF ot 26 yanvarya 2010g. № 29. http://www.gost.ru/wps/wcm/connect/8e2a7c00455e4860ae 95bfe4dfffd2ca/Post_Prav_26.01.2010_%E2%84%96+29. pdf?MOD=AJPERES (20 February 2014). (Технический регламент о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии: утв. постановлением Правительства РФ от 26 янв. 2010 г. № 29.)
2. Gadegaard N. Atomic force microscopy in biology: technology and techniques. Biotechnic & Histochemistry 2006; 81: 87-97.
3. Lekka M, Fornal M, Pyka-Fosciak G, et al. Erythrocyte stiffness probed using atomic force microscope. Biorheology 2005; 42: 305-317.
4. Hertz H. Uber die Beruhrung fester elastischer Korper. Journal fur die reine und angewandte Mathematik 1981; 92: 156-171.
5. Ikai A, Afrin R, Sekiguchi H, et al. Nano-mechanical methods in biochemistry using atomic force microscopy. Current Protein and Peptide Science 2003; 4:181-193.
6. Lebedev DV, Chuklanov AP, Bukharaev AA, et al. Izmerenie modulya Yunga biologicheskikh ob"ektov v zhidkoy srede s pomoshch'yu spetsial'nogo zonda atomno-silovogo mikroskopa. Pis'ma v ZhTF 2009; 35 (8): 54-61 (Лебедев Д. В., Чукланов А. П., Бухараев А. А. и др. Измерение модуля Юнга биологических объектов в жидкой среде с помощью специального зонда атомно-силового микроскопа. Письма в ЖТФ 2009; 35:54-61.)
/ 19.01.2015